Exercice n°5 (BTS AB 2006)
Le numéro atomique du sodium est Z = 11.
L’analyse du spectre d’émission d’une lampe à vapeurs de sodium révèle la présence de raies de longueurs d’ondes bien définies :

1. Donner la structure électronique de l’atome de sodium.
2. A quels domaines de longueurs d’onde appartiennent ces radiations ?
3. Calculer la fréquence de la radiation jaune de longueur d’onde l = 589.0 nm.
4. Calculer en joule et en électronvolts, l’énergie des photons associés à cette radiation.
5. En utilisant le diagramme simplifié des niveaux d’énergie de l’atome de sodium (celui de l’exercice précédent), vérifier que cette radiation correspond à la transition de l’état excité 1 vers l’état fondamental.
6. Un atome de sodium à l’état fondamental peut-il absorber un photon d’énergie 3 eV ? justifier votre réponse.
Corrigé
1. Structure électronique de l’atome de sodium (Z=11). Na : 1s² 2s² 2p6 3s1 .
2. On a l= 400 nm < domaine visible < l=750 nm .
Si l< 400 nm on est dans le domaine UV (tant que l> 10 nm).
Si l > 750 nm on est dans le domaine IR jusque vers 10-3m.
Donc :
· l1 appartient au domaine des UV.
· l2, l3, l4 appartiennent au domaine visible.
· l5 et l6 appartiennent aux infrarouges.
3. On a n3 = ![]() = 5.09 1014 Hz.
= 5.09 1014 Hz.
4. Eph3 = h.n3
= 3.37 10-19J soit Eph3 = 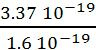 = 2.11 eV.
= 2.11 eV.
5. On a E2 – E1 = -3.03-(-5.14) = 2.11 eV donc on a bien Eph3 = E2 – E1. L’émission de ce photon correspond bien à cette transition.
6. Si l’atome pouvait absorber un tel photon, il existerait un niveau d’énergie En tel que
En = E1 + 3 = -2.14 eV. Or, ce niveau d’énergie n’existe pas, donc l’atome de sodium ne peut pas absorber un tel photon.