Exercice n°1
Pile Bouton.
On dispose d’une pile
bouton dont le schéma est donné ci-dessous.
Sa force électromotrice
est de 1.35V.
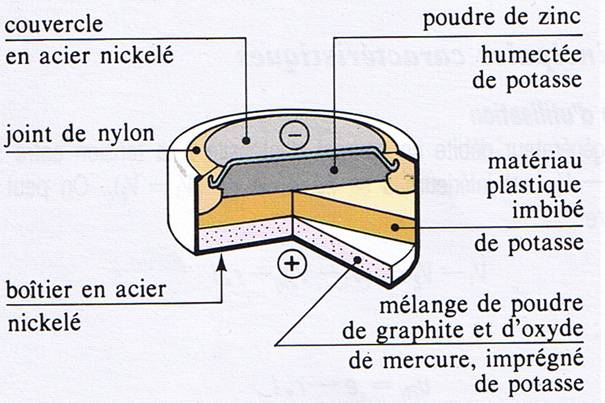
1. La réaction entre les ions zinc et la potasse (K++OH-)
forme le complexe Zn(OH)42-.
Ecrire l’équation de formation de ce complexe.
2. Quel est le rôle du graphite dans la partie inférieure
de la pile ?
3. Ecrire les équation rédox qui ont lieu aux électrodes
(d’abord sans tenir compte du milieu puis en milieu basique en équilibrant à
l’aide d’OH- au lieu de H+) couples : Zn2+/Zn
( milieu basique Zn(OH)42-/Zn) et HgO/Hg.
4. Cette pile bouton se présente sous la forme d’un
disque de 4mm d’épaisseur et de 1cm de diamètre. Elle peut débiter un courant
de 100mA pendant 1000h.
a- Déterminer sa capacité.
b- Déterminer son énergie totale.
c- Déterminer son énergie volumique.
d- Quelle masse minimale de zinc doit-elle
contenir ? (MZn = 65.4 g.mol-1).
Corrigé
1. Zn2+ + 4 OH- = Zn(OH)42-
( réaction limitée).
2. Le graphite sert de conducteur
puisque l’oxyde de mercure est un isolant.
3. Au pole négatif : Zn = Zn2+
+ 2é soit en milieu basique : Zn + 4 OH- = Zn(OH)42- + 2é .
Au pole positif : HgO +2 H+ + 2é = Hg + H2O
soit en milieu basique HgO +2 H+ + 2é +2 OH- = Hg +
H2O +2OH- (on a ajouté autant de OH-
qu’il y avait d’ions H+)
Qui devient HgO + 2 H2O + 2é = Hg + H2O +2OH-
(Les H+ et les OH- ont formé de l’eau).
Et finalement : HgO + H2O
+ 2é = Hg + 2OH- .
4. I = 100 10-6 A et Dt = 1000h.
a- Q = I. Dt = 0.1 Ah = 360 C
b- W = Q.E = 486J
c- Wv = W/V = 486 /(4.10-3xp(0.510-2)²) = 1.55 109
J.m-3 soit 1.55 kJ.cm-3.
d- On a Q = ne.F donc ne
= Q/F = 360/96450 = 3.73 10-3 mol.
La quantité minimum de
zinc nécessaire,n0, est celle qui permettrait de produire ne
mol d’électrons.
|
|
Zn |
+ 4OH- |
= Zn(OH)42- |
+ 2é |
|
EI |
n0 |
excès |
0 |
0 |
|
EF |
n0
– x = 0 |
excès |
x |
2x = ne |
Détermination de x :
On a x = ne /2=
1.87 10-3 mol et n0 = x = 1.87 10-3mol.
Donc mZn = n0.MZn
= 0.122 g.