Exercice n°2
Accumulateur au plomb
Un accumulateur au plomb
(batterie de voiture) peut être schématisé par une électrode de plomb et une
électrode inerte recouverte de dioxyde de plomb plongées dans une même solution
contenant de l’acide sulfurique et du sulfate de plomb.
1. Ecrire les deux demi-équations redox ainsi que la
réaction naturelle de la pile. E0Pb2+/Pb = - 0.13V et E0PbO2/Pb2+
= 1.45V.
2. Quelle est la force électromotrice de cette pile en conditions
standards ?
3. Sachant qu’on est en solution aqueuse et en milieu
acide, montrer que PbO2 et Pb sont consommés par des réactions
parasites même lorsque l’accumulateur est en circuit ouvert. E0O2/H2O
= 1.23V et E0H+/H2
= 0.00V.
4. Cette batterie a une capacité
de 133 Ah et elle est employée sous une intensité de 90A pour le démarrage de
la voiture. Quelle masse minimum de dioxyde de plomb doit-elle contenir ?
MPb = 207 g.mol-1 et MO = 16g.mol-1.
Corrigé
1. On a au pole négatif (production d’électrons)
Pb = Pb2+ + 2é.
Au pole positif (consommation d’électrons) PbO2 + 4 H+
+ 2é = Pb2+ + 2 H2O
2. En conditions standards on a E = E+
- E- = E0PbO2/Pb2+ - E0Pb2+/Pb
= 1.58V
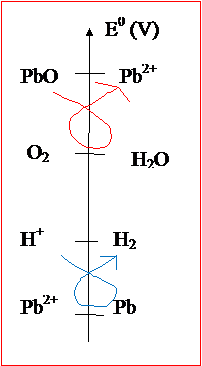
3. On peut représenter les couples sur
une échelle :
On remarque que l’électrode recouverte de PbO2 peut réagir
avec l’eau (gamma rouge), et que celle en plomb peut réagir avec les ions H+
de l’acide sulfurique (gamma bleu).
4. On a Q = 133 Ah = 133x3600 = 4.79 105
C et Q = ne.F soit ne = Q/F =
4.79 105/96450 = 4.97 mol
La quantité minimum, n0 de dioxyde de plomb que contient cette
pile réagira avec ne électrons.
|
|
PbO2 |
+ 4 H+ |
+ 2é |
= Pb2+ |
+ 2 H2O |
|
EI |
n0 |
excès |
ne |
0 |
excès |
|
EF |
n0
– x = 0 |
excès |
ne
– 2x =0 |
x |
excès |
Détermination de x :
On a x = ne /2=
2.49 mol et n0 = x = 2.49 mol.
Donc mPbO2 = n0.MPbO2
= 595 g.