Exercice n°3
Electrolyse
d’une solution de chlorure de sodium (saumure).
On réalise l’électrolyse
du chlorure de sodium sous une tension de 3.8V et une intensité de 45kA.
On observe un dégagement
de dichlore à l’anode et un dégagement de dihydrogène
à la cathode.
1. Faire la liste des espèces chimiques en solution et en
déduire qui sont les meilleurs oxydants et réducteurs présents.
E0Na+/Na
=-2.71V ; E0H2O/H2 =-0.42V (équivalent du
couple H+/H2 en milieu basique qui s’équilibre avec OH-) ;
E0O2/H2O =0.81V ; E0Cl2/Cl-=2.4V
2. L’électrolyse observée est-elle celle qui était
prévisible (justifier) ? Comment expliquer ce résultat ?
3. Calculer la masse de dichlore
produite en 1 jour (MCl = 35.5g.mol-1).
4. Quelle est l’énergie consommée par tonne de dichlore produite ?
Corrigé
1. La liste des espèces chimiques en
solution est : H2O, Na+, Cl-. H+
et OH- sont présents en quantités très faibles.
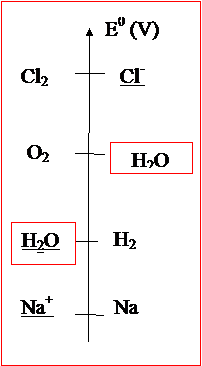
2. On représente sur une échelle les
couples présents, on souligne les espèces présentes et on identifie le meilleur
oxydant et le meilleur réducteur. C’est la réaction entre le meilleur oxydant
et le meilleur réducteur qui est prévue.
|
On remarque
que le meilleur oxydant est l’eau et que le meilleur réducteur est l’eau. On devrait
observer l’électrolyse de l’eau qui produit O2 et H2,
ce
n’est pas celle qui est observée puisqu’il y a production de Cl2
(Cl2/Cl-) et de H2
(H2O/H2). Il y a
eu un phénomène de surtension à l’anode, l’électrode
où a lieu l’oxydation. |
|
3. On a Q = I.Dt = 45 103x24x3600 = 3.89
109 J donc comme Q = ne.F, on a
ne = Q/F = 4.03 104 mol.
La quantité produite de dichlore, nCl2,
est produite en même temps que ne mol d’électrons.
|
|
2 Cl- |
= Cl2 |
+ 2é |
|
EI |
n0 |
0 |
0 |
|
EF |
n0
– 2x |
x = nCl2 |
2x = ne |
On a donc :
x = ne /2= 2.02
104 mol et nCl2 = x = 2.02 104 mol.
Soit mCl2 = nCL2 . MCl2 = 1.43 106 g
soit 1.43 tonnes.
4. L’énergie consommée pendant ce temps
est W = UAB.I.Dt = 3.8x45000x24x3600 = 1.48 1010J
= 1.48 1010/3.6 106 =4.10 103 kWh.
Comme on a produit 1.43 tonne pendant le même temps, l’énergie consommée
par tonne est :
Wt = 1.48 1010/1.43 = 1.03 1010J
= 2.87 kWh