Exercice n°4
Electrolyse d’une solution de sulfate
de cuivre à anode soluble (voir TP). E0Cu2+/Cu = 0.34V.
1. Faire un schéma de cette électrolyse (l’anode est en
cuivre et la cathode en graphite).
2. Quelle est la force contre électromotrice de l’électrolyseur
dans ces conditions ?
3. Comment varie la concentration en ions Cu2+
dans la solution, d’après l’équation de cette électrolyse ?
4. L’anode est un fil de 1mm de diamètre et de 4 cm de
long (cylindre). L’intensité qui traverse l’électrolyseur est de 200 mA. Au bout
de combien de temps l’anode sera-t-elle totalement consommée ?
Donnée : Masse
volumique du cuivre : r = 8.92 103 kg.m-3 et MCu = 63.5 g.mol-1.
Corrigé
1. Schéma du montage :
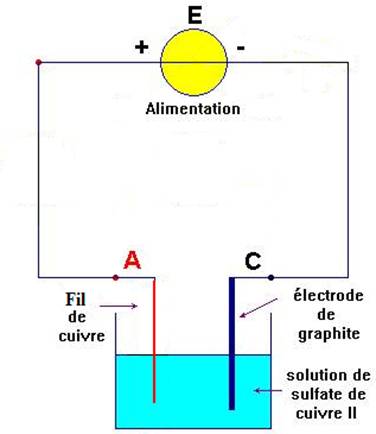
2. La force contre électromotrice de l’électrolyseur
correspond à la tension minimum à appliquer pour que l’électrolyse ait lieu. Il
s’agit de la différence entre les potentiels des deux couples qui interviennent
dans l’électrolyse. Or, ici, le bilan de l’électrolyse est Cu2+ + Cu
= Cu2+ + Cu, c'est-à-dire que les deux couples qui interviennent
sont Cu2+/Cu et Cu2+/Cu !
La force contre électromotrice est donc E’0 = E0Cu2+/Cu
- E0Cu2+/Cu = 0.0 V
3. L’équation bilan montre qu’il y a
transfert de matière d’une électrode à l’autre, mais il n’y a pas variation de
la concentration en ions cuivres : Cu2+ + Cu = Cu2+
+ Cu. Chaque fois qu’un Cu2+ est consommé, un autre est produit.
4. Réaction à l’anode (oxydation) :
Afin
que l’anode soit entièrement consommée, il faut consommer n0 mol de
cuivre et donc former ne mol d’électrons.
|
|
Cu |
= Cu2+ |
+ 2é |
|
EI |
n0 |
excès |
0 |
|
EF |
n0
– x = 0 |
excès |
2x = ne |
On a m0 = r. V et V = (p.r²).l = (px(0.5.10-3)²x4.10-2
= 3.14 10-8 m3 . donc m0 = 2.80 10-4
Kg = 2.8 10-1g.
Et n0 = ![]() = 0.0043 mol.
= 0.0043 mol.
Donc x = 0.0043 mol et ne = 2x = 0.0086 mol. Soit Q = ne.F
=830 C
Comme Q = I.Dt on a Dt = ![]() =
4150 s soit 1h 9 minute et 10 secondes (mais tous les chiffres ne sont pas
significatifs).
=
4150 s soit 1h 9 minute et 10 secondes (mais tous les chiffres ne sont pas
significatifs).
On
arrondira à Dt = ![]() =
4.2 103 s.
=
4.2 103 s.