Exercice n°5
1. On veut nickeler un objet en cuivre. Peut-on
y arriver en le plongeant dans un bain de sulfate de nickel (Ni2+ +
SO42-) ?
2. On procède à un dépôt par
électrolyse. Indiquer un schéma possible de protocole expérimental.
3. On veut déposer sur une plaque polie
(sur une seule face) d’aire 350 cm2, une couche de 0.02 mm de
nickel. Quelle est la masse de nickel nécessaire ?
4. Quelle la charge électrique qui a été
transférée d’une électrode à l’autre pour obtenir ce résultat ?
Masse volumique du Nickel : r = 8.90 103 kg.m-3
MNi = 58.7 g.mol-1. E0Cu2+/Cu
= 0.34V et E0Ni2+/Ni = -0.23V
Corrigé
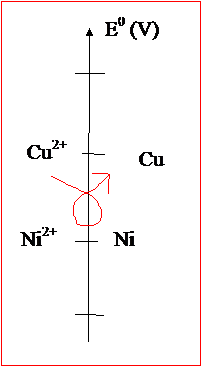
1. La réaction naturelle entre les deux
couples est : Cu2+ + Ni = Ni2+ + Cu (gamma à l’endroit)
|
On ne
peut donc pas produire du nickel avec la réaction naturelle. Il n’est donc
pas possible de déposer du nickel sur l’objet en cuivre simplement en le
trempant dans une solution contenant des ions nickel. |
|
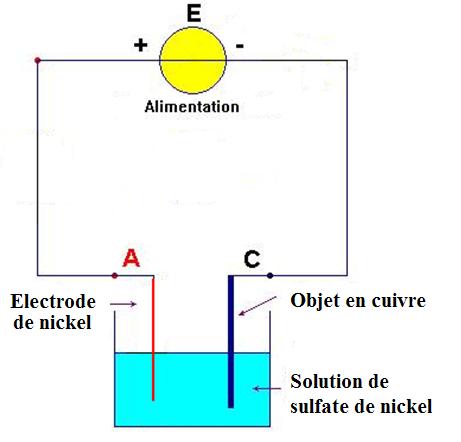
2. Schéma de l’électrolyse :
3. Le volume nécessaire de nickel est V
= Sxe = 350 10-4x0.02 10-3 = 7.0 10-7 m3.
La masse nécessaire est m = r.V = 6.23 10-3 kg = 6.23
g.
4. Au niveau de l’électrode de nickel on
a observé la réaction suivante :
Il reste encore du nickel en fin d’expérience, mais la quantité de nickel
qui a disparue, et qui a été déposée sur l’objet est x, dans le même temps il a
été produit ne mol d’électrons.
|
|
Ni |
= Ni2+ |
+ 2é |
|
EI |
n0 |
excès |
0 |
|
EF |
n0
– x |
excès |
2x = ne |
On a x = ![]() = 0.106 mol. Il s’agit de la quantité
de nickel transférée d’une électrode à l’autre.
= 0.106 mol. Il s’agit de la quantité
de nickel transférée d’une électrode à l’autre.
Donc x = 0.106 mol et ne = 2x = 0.212 mol. Soit Q = ne.F
=2.05 104 C