Exercice n°1 :
Le
dioxyde de carbone est un des gaz responsables de « l'effet de serre ». Le
fonctionnement des moteurs d'automobiles est l'une des causes importantes de
rejet de CO2 dans l'atmosphère. On peut considérer que l'essence est
constituée principalement par de l'octane.
1.
Un réservoir d'automobile contient 40 L d'essence, soit une masse de 27 kg
environ d'octane. Quelle est la quantité de matière (en mol) d'octane
correspondant à un plein d'essence ?
2.
La combustion de l'octane, dans un moteur bien réglé, correspond à la réaction
de combustion complète (DrG0 = -5512
kJ.mol-1).
Déterminer
le volume de dioxyde de carbone rejeté dans l’atmosphère ainsi que l’énergie
libérée par la combustion complète des 40L d’essence. (Vm = 25L.mol-1
dans ces conditions).
3.
On admet que la voiture fait 600 km avec un plein d’essence, déterminer la masse
de CO2 rejetée au kilomètre.
Corrigé
Exercice n°2 :
Montrez
comment il est possible de faire les transformations suivantes
a.
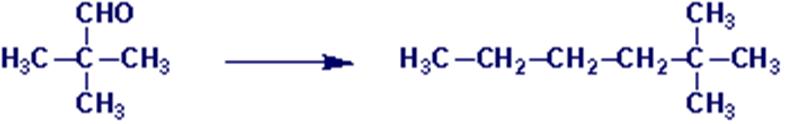
b.
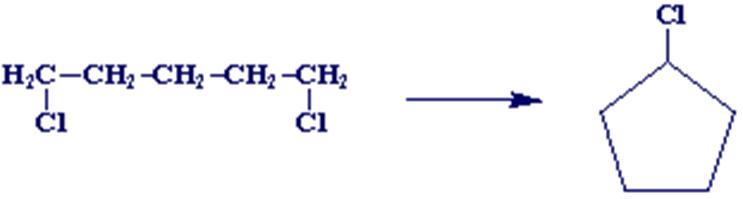
c.
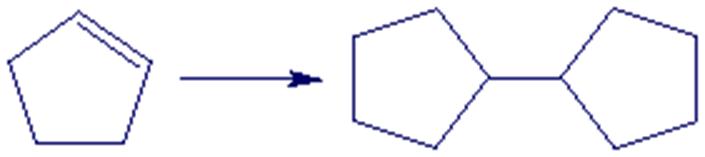
Corrigé
Exercice n°3 :
Lors de la synthèse en
laboratoire du butane à partir de l’équation suivante on obtient aussi du
propane. Comment peut-on expliquer la présence du propane ?
![]()
Corrigé
Exercice n°4 :
Remplacez
les lettres par les formules semi-développées.
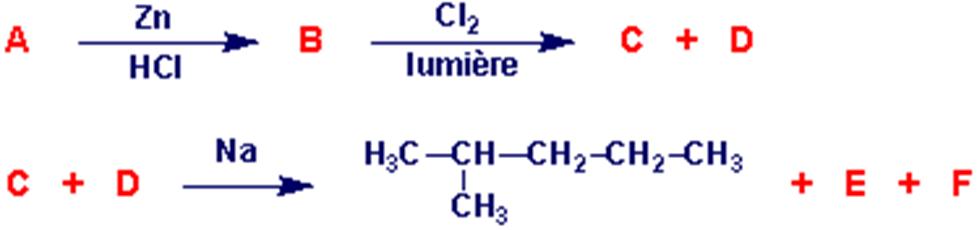
Corrigé
Exercice n°5
Expliquer en détail le
mécanisme de la monochloration d’un alcane.