Exercice n°6
On effectue
l’électrolyse de l’iodure d’hydrogène (H++I-). On observe
un dégagement de dihydrogène sur une des électrodes et une coloration jaune,
caractéristique du diiode au niveau de la seconde
électrode.
1. Ecrire les équations de réactions qui ont lieu aux
deux électrodes. Préciser à quelle borne du générateur elles ont lieu.
2. L’électrolyse observée est-elle celle qui était
prévisible ? Justifier.
Données :
E0H+ /H2 =0.00V ; E0O2/H2O =1.23V ;
E0I2/I-=0.62V
Corrigé
1. Il y a formation de dihydrogène :
2H+ + 2é = H2 cette réaction nécessite des électrons,
elle a donc lieu à la borne négative du générateur qui peut les fournir.
Il y a formation de diiode : 2I-
= I2 + 2é. Cette réaction à lieu à la borne positive du générateur
qui peut « récupérer » les électrons formés.
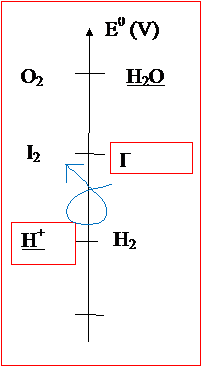
2. On fait la liste des espèces
chimiques en solution : H2O, H+, I- les
autres espèces sont en quantité négligeables.
On souligne ces espèces sur l’échelle redox et on détermine qui est le
meilleur oxydant présent et le meilleur réducteur présent :
|
Le
meilleur oxydant présent est H+ et le meilleur réducteur présent
est I-. L’électrolyse
prévue est celle qui fait intervenir ces deux couples : H+/H2
et I2/I-. C’est
bien l’électrolyse prévue qui est observée. |
|