Exercice n°1
Sujet de baccalauréat STL-BGB
1997
On réalise une pile
électrochimique afin de déterminer le produit de solubilité du sulfate d’argent
Ag2SO4
On réalise pour cela deux
demi-piles.
· Première demi-pile : On dissout, sans variation
de volume, 20.4g de nitrate d’argent (AgNO3) dans 150 mL d’eau pure.
Un fil d’argent sert d’électrode.
· Deuxième demi-pile : le bécher contient une
solution saturée de sulfate d’argent en présence d’un excès de sulfate de
sodium. L’électrode est un fil d’argent.
· Les deux demi-piles sont reliées par un pont
électrolytique.
1.
Exprimer et
calculer le potentiel de la première demi-pile.
2.
La force
électromotrice de la pile est égale à 0.120 V.
2.1
Calculer le
potentiel de la deuxième demi-pile et en déduire la concentration molaire des
ions Ag+.
2.2
Faire un schéma
de la pile en justifiant les polarités des électrodes.
3.
La concentration
en ions SO42- dans la deuxième demi-pile vaut 0.25 mol.L-1.
Calculer le produit de solubilité du sulfate d’argent.
4.
Calculer la
solubilité de Ag2SO4 dans l’eau
pure.
Données :
MAg = 108 g.mol-1
MN = 14 g.mol-1 MO = 16 g.mol-1 MS
= 32 g.mol-1
E0Ag+/Ag
= 0.80 V
Exercice n°2
On
réalise une pile en plongeant une lame de zinc dans une solution de chlorure de
zinc telle que [Zn2+] = 0.10 mol.L-1 et une lame de
nickel dans une solution de chlorure de nickel telle que [Ni2+] =
0.10 mol.L-1. Les deux demi-piles sont reliées par un pont
électrolytique.
La
pile débite dans un conducteur ohmique.
1.
Faire un schéma de la pile sur lequel seront
indiqués, les sens de déplacement des électrons et du courant électrique à
l’extérieur de la pile.
Déterminer la force électromotrice de cette pile.
2.
Ecrire l’équation de fonctionnement de cette pile.
Déterminer la constante d’équilibre de cette pile.
3.
Au bout d’un moment, la force électromotrice de la pile est E=0.45V.
Déterminer le rapport [Zn2+]/[Ni2+]
à cet instant.
Données :
E0Zn2+/Zn
= -0.76 V et E0Ni2+/Ni = -0.25 V.
Exercice n°3
1- On plonge une électrode de platine dans une solution
contenant les ions aux concentrations suivantes :
[Cr2O72-]
= 10-2 mol.L-1, [Cr3+] = 10-3 mol.L-1,
à pH=1.
a-
Donner
l’expression du potentiel pris par l’électrode de platine.
b- Calculer ce potentiel.
2- On plonge une autre électrode de platine dans une
solution contenant les ions aux concentrations suivantes :
[Fe2+]
= 10-3 mol.L-1, [Fe3+] = 10-1 mol.L-1.
Déterminer le potentiel de cette électrode.
3- On relie ces deux demi-piles par un pont
électrolytique.
a-
Faire un schéma
de la pile sur lequel on indiquera la polarité de chaque électrode ainsi que le
sens de circulation des électrons lorsque la pile débite dans un conducteur
ohmique.
b- Déterminer la force électromotrice, E, de cette pile.
c-
Ecrire l’équation
de fonctionnement de cette pile.
Données :
E0Cr2O72-/Cr3+
= 1.33 V et E0Fe3+/Fe2+ = 0.77 V
Exercice n°4
Afin de réaliser une pile, on
constitue deux demi-piles qu’on relie à l’aide d’un pont électrolytique. La
première demi-pile est constituée d’une lame d’argent plongeant dans une
solution de nitrate d’argent de concentration 0.2 mol.L-1. La
seconde est constituée d’une lame d’argent plongeant dans une solution de
chlorure d’argent saturée.
1.
Faire un schéma
de la pile.
2.
La première
électrode est le pôle positif de cette pile, et la force électromotrice de la
pile est E=0.25V. Déterminer les potentiels des deux électrodes.
3.
En déduire la
concentration en ions Ag+ dans la seconde demi-pile et calculer le
produit de solubilité du chlorure d’argent Ks.
4.
En déduire le pKs et la solubilité de AgCl en g.L-1.
Exercice n°5
Dans
cet exercice, les valeurs numériques calculées seront données avec 3 chiffres
significatifs
On
réalise une pile avec les deux demi-piles suivantes : Pb/Pb2+ // H+ / ClO3-
/ Cl-/ Pt
1) a) Écrire la demi-équation
électronique correspondant au couple ClO3-/ Cl- en
milieu acide.
b)
Calculer le potentiel pris par un fil de platine plongeant dans une solution contenant
0,200 mol.L-1 d'ions ClO3-,
0,180 mol.L-1 d'ions Cl-,
et de pH = 1.
2) a) Écrire la demi-équation
électronique correspondant au couple Pb2+ / Pb.
b)
Calculer le potentiel pris par une lame de plomb plongeant dans une solution de
nitrate de plomb de concentration 0,500 mol.L-1.
3) Calculer la force
électromotrice de la pile au début de son fonctionnement
4) On réalise une pile avec
les deux demi-piles précédentes :
Faire un schéma de cette pile.
Préciser les réactions qui s'effectuent dans chaque
demi-pile et l'équation de fonctionnement de la pile.
Où s’effectue la réaction de réduction ? La
réaction d’oxydation ?
Préciser les pôles positif et négatif de la pile,
justifier la réponse.
Préciser le sens du courant, le sens de circulation
des électrons.
5)
Au bout de 30 min, il a disparu 0,150 mol.L-1 d’ions ClO3-.
Au cours de cette transformation, le volume de
chaque compartiment (100mL) reste constant.
A l’aide d’un tableau d’avancement, déterminer les
concentrations des ions présents.
La solution étant très acide, on admet que les ions
H+ sont introduits en large excès et donc que leur concentration ne
varie pas.
Calculer la force électromotrice de la pile à ce
moment là.
6)
Expliquer à quel moment une pile arrête de fonctionner ; on dit alors que
la pile est usée.
Données : E0 (ClO3- / Cl-)
= 1,450 V E0 (Pb2+
/ Pb) = - 0,126 V.
Exercice n°6
On considère la pile représentée ci-dessous :
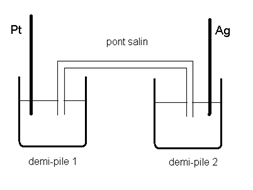
La demi-pile 1 est constituée d’une électrode de
platine plongeant dans une solution de permanganate de potassium (K+,MnO4-) acidifiée dans laquelle :
[MnO4-] =
0,01 mol/L; [Mn2+] = 0,02 mol/L; [HO3+] =
0,08 mol/L.
La demi-pile 2 est constituée d’une électrode d’argent
plongeant dans une solution de nitrate d’argent (Ag+,NO3-)
de concentration O,1 mol/L.
1-Exprimer puis calculer la conductivité de la
solution de nitrate d’argent
2-Exprimer puis calculer les potentiels des électrodes
de platine et d’argent.
3-Calculer la force électromotrice en début de
fonctionnement
4-Ecrire les réactions se produisant à chacune des
électrodes et en déduire l’équation bilan lorsque la pile débite.
5-Comment évoluent les concentrations des espèces
ioniques quand la pile débite ?
6-Au bout de 30 minutes d’utilisation la concentration
en ions permanganate MnO4- est égale à 0,005 mol/L.
Calculer les concentrations en ions Mn2+ et H30+
au bout de 30 minutes d’utilisation.
Données à 25°C :
E°( MnO4-/
Mn2+) = 1,51 V E°(Ag+/Ag)
= 0,8 V
lAg+) = 62.10-4 S.m2.mol-1 et l(NO3-) = 72.10-4 S.m2.mol-1