Exercice n°1
1. Etablir les structures électroniques des atomes suivants : 7N, 1H, 6C, 14Si, 8O, 5B, 9F, 16S, 15P, 17Cl, 53I.
2. En déduire les formules de Lewis puis les types VSEPR et les géométries des molécules et ions suivants. On fera un schéma afin de justifier les géométries et on discutera de l avaleur des angles entre les liaisons.
a- NH3.
b- CH4.
c- SiO2.
d- BF3.
e- H3O+.
f- PCl5.
g- SF6.
h- ICl3.
i- NH4+.
Corrigé
Exercice n°2
Les éléments aluminium (Al ; Z=13) et chlore (Cl; Z=17)
amènent à la formation du trichlorure d’aluminium AlCl3 et de
l’ion AlCl4-.
a-
donner la
configuration électronique de ces deux atomes ainsi que la répartition de leurs
électrons dans leurs cases quantiques de la couche externe.
b-
En déduire leur
représentation de Lewis.
c-
Expliquer la
formation des liaisons dans AlCl3 et indiquer la géométrie de cette
molécule (faire un schéma). Discuter de la valeur des angles de liaisons.
d-
Expliquer la
formation des liaisons dans AlCl4- et indiquer la
géométrie de cet ion (faire un schéma). Discuter de la valeur des angles de
liaisons.
e-
Sous l’élément
aluminium dans le tableau périodique, on trouve l’élément Ga (Galium) Z=31.
Donner sa configuration électronique ainsi que la répartition des électrons
dans les cases quantiques de sa couche externe. Quelle caractéristique partage
t’il avec l’aluminium ?
Corrigé
Exercice n°3
A l’aide de la méthode VSEPR, analyser chacun des carbones
des molécules suivantes afin de connaître leur « type » et leur
géométrie.
En déduire si la molécule
complète est plane ou non plane.
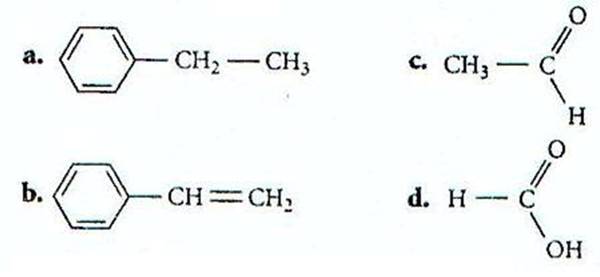
Corrigé
Exercice n°4
On donne les numéros atomiques des éléments suivants :
C : Z=6 ; H : Z=1 ; S : Z=16 ;
O :Z=8 et Cl :Z=17.
Donner les géométries des molécules suivantes en les
analysants avec la méthode VSEPR. Indiquer le type de chacun des atomes
centraux, analyser successivement chacun des atomes centraux lorsqu’il y en a
plusieurs.
|
a-
C2H6 b-
C2H2 c- OCCl2 |
c-
CH2Cl2 d-
C2H4 |