Données : h = 6.63 10-34 J.s c = 3.00 108 m.s-1 1 eV = 1.6 10-19 J
Exercice n°1
On donne le diagramme des niveaux d’énergie du sodium.

1. Que signifie le terme « quantifié », lorsqu’on dit que les niveaux d’énergie de l’atome de sodium sont quantifiés ?
2. Déterminer la longueur d’onde du photon émis lorsque l’atome de sodium se désexcite de son état E3 vers son état fondamental. A quel domaine des ondes électromagnétiques ce rayonnement appartient-il ?
3. Lorsqu’il est en état E3, le sodium peut-il émettre un photon de fréquence 2.66 1014 Hz ?
4. Quelle est l’énergie d’ionisation de l’atome de sodium ?
5. Quel type se spectre obtient-on avec une lampe à vapeurs de sodium (non ionisé) ? A quoi ressemble-t-il ?
Corrigé
Exercice n°2 Bac STL BGB 2005
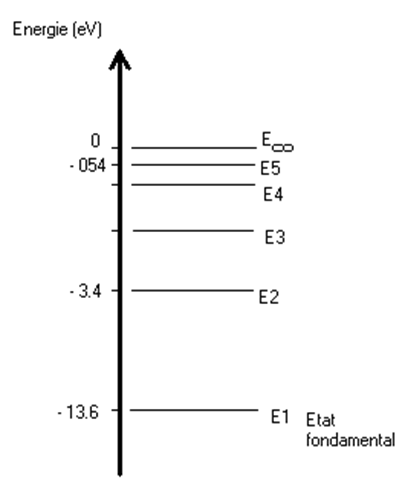
On a le
diagramme des niveaux d’énergie de l’atome d’hydrogène.
On donne les
constantes suivantes : c= 3,0.108 m.s-1 ; h =
6.62 10-34 J.s
On donne la
conversion suivante : 1 eV = 1.6 10-19 J.
1.
Quelle est en
Joule l’énergie d’ionisation de l’atome d’hydrogène au repos?
2.
L’atome
d’hydrogène est dans l’état excité E5, il se désexcite et passe dans
l’état E2. Sous quelle forme l’énergie est-elle libérée ?
Calculer l’énergie libérée en joule.
3.
Lorsqu’il est
dans son état fondamental, l’atome d’hydrogène est capable d’absorber un photon
de longueur d’onde 97.3 nm. Il passe alors dans l’état d’énergie E4.
Calculer la valeur de l’énergie de E4, qu’il faut reporter sur le
diagramme.
4.
Expliquer le
mécanisme d’absorption d’un photon par l’atome d’hydrogène.
5.
Si on réalise une
lampe à vapeurs d’hydrogène (non ionisé), quel type de spectre lumineux
obtiendra t-on en décomposant la lumière émise ?
Corrigé
Exercice n°3
On donne deux spectres (incomplets) obtenus à l’aide de vapeurs de mercure.
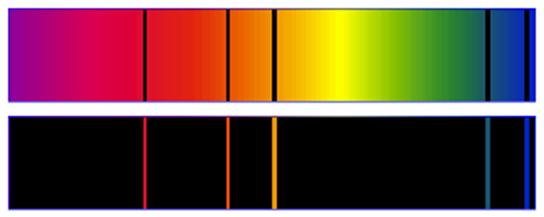
1. Quel est le spectre d’émission ? Quel est le spectre d’absorption ?
2. Faire un schéma simple indiquant comment on peut réaliser un spectre d’absorption de manière générale.
3. On trouve dans un document l’énergie d’ionisation du mercure : 1007 kJ/ mol. Déterminer l’énergie d’ionisation d’un atome de mercure en eV.
4. Déduire de la question précédente l’énergie de l’état fondamental de l’atome de mercure.
5. Les longueurs d’onde du doublet jaune représenté ci-dessus sont 578 et 579 nm. Construire une ébauche de diagramme simplifié des niveaux d’énergie du mercure permettant d’expliquer l’émission de ces raies. On admettra que l’émission de ces photons ramène à l’état fondamental.
6. Quelles informations faut-il pour construire le diagramme des niveaux d’énergie du mercure de manière complète ?
Données : NA = 6.02 1023 mol-1.
Corrigé
Exercice n°4

On analyse au
moyen d’un spectroscope, la lumière émise par une lampe à vapeur de sodium. Le
spectre est constitué de raies.
1.
Pourquoi ce
spectre est il appelé « spectre d’émission » ?
2.
A l’aide du
diagramme ci contre, interpréter la discontinuité du spectre.
3. La raie la plus intense est celle correspondant à la
transition entre le niveau d’énergie 2 et le niveau fondamental. Déterminer sa
longueur d’onde et sa fréquence. A quel
domaine des ondes électromagnétiques ce rayonnement appartient-il ?
4.
Lorsque l’atome
de sodium est en état d’énergie 4, quels photons est-il capable d’absorber
d’après le diagramme ci-contre ? (indiquer leurs énergies en eV)
5.
Calculer
la longueur d’onde du photon de plus petite énergie de la question 5.
Corrigé
Exercice n°5 (BTS AB 2006)
Le numéro atomique du sodium est Z = 11.
L’analyse du spectre d’émission d’une lampe à vapeurs de sodium révèle la présence de raies de longueurs d’ondes bien définies :

1. Donner la structure électronique de l’atome de sodium.
2. A quels domaines de longueurs d’onde appartiennent ces radiations ?
3. Calculer la fréquence de la radiation jaune de longueur d’onde l = 589.0 nm.
4. Calculer en joule et en électronvolts, l’énergie des photons associés à cette radiation.
5. En utilisant le diagramme simplifié des niveaux d’énergie de l’atome de sodium (celui de l’exercice précédent), vérifier que cette radiation correspond à la transition de l’état excité 1 vers l’état fondamental.
6. Un atome de sodium à l’état fondamental peut-il absorber un photon d’énergie 3 eV ? justifier votre réponse.