Exercice n°1
On prélève 10 mL d’une solution d’acide chlorhydrique
de concentration 0.05 mol.L-1 que l’on met dans un bécher. On dilue
de manière à obtenir un volume total de 500 mL.
1- Déterminer
la concentration des ions après dilution.
2- Quelle est la conductivité de la solution contenue
dans le bécher ?
3- On ajoute à ce bécher 1.50g de chlorure de sodium
qu’on dissout totalement après agitation. Déterminer la nouvelle conductivité
de la solution.
Données : On donne les mobilités des ions suivants en unité
SI.
lCl- =
76.10-4. lNa+ =
50.10-4. lOH- =
198.10-4. lH3O+ =
350.10-4.
On donne les masses molaires suivantes :
MCl =
Corrigé
Exercice n°2
Une
solution d’ammoniaque (NH4+/NH3 ;
l’ammoniaque est une base faible) est dosée par une solution d’acide
chlorhydrique à 10-1 mol.L-1.
1- Ecrire les équations de mise en solution puis
l’équation de réaction du dosage.
2- Ce dosage est suivi par conductimétrie. Les résultats,
lorsqu’on dose 20 mL de la solution d’ammoniaque, sont dans le tableau
ci-dessous. En début de dosage on a amené le bécher à 250 mL avec de l’eau
distillée.
|
V (ml) |
0 |
1 |
2 |
3 |
4 |
5 |
||
|
σ
(S.m-1) |
2.0 10-3 |
6.0 10-3 |
1.0 10-2 |
1.4 10-2 |
1.9 10-2 |
2.3 10-2 |
||
|
V (mL) |
6 |
7 |
8 |
9 |
9.5 |
10 |
||
|
σ (S.m-1) |
2.9 10-2 |
3.2 10-2 |
3.6 10-2 |
4.1 10-2 |
4.3 10-2 |
4.5 10-2 |
||
|
V (ml) |
10.5 |
11 |
12 |
13 |
14 |
15 |
||
|
σ
(S.m-1) |
4.9 10-2 |
5.3 10-2 |
6.2 10-2 |
7.0 10-2 |
7.9 10-2 |
8.7 10-2 |
||
|
V (mL) |
16 |
17 |
18 |
19 |
20 |
|
||
|
σ (S.m-1) |
9.6 10-2 |
10.4 10-2 |
11.3 10-2 |
12.2 10-2 |
13.0 10-2 |
|
||
2-1 Représenter la courbe σ en fonction de V.
2-2 Justifier l’allure de la courbe obtenue.
2-3 Etablir le tableau d’avancement, puis calculer la concentration
molaire de la solution d’ammoniaque.
2-4 Quelles sont les concentrations des différentes espèces chimiques à
l’équivalence ? En déduire la conductivité de la solution à l’équivalence.
2-5 Faire un schéma légendé du montage.
2-6 Pour réaliser ce dosage on a mis l’ammoniaque dans un bécher puis
on a ajouté de l’eau distillée afin d’obtenir un grand volume de solution.
Pourquoi à t’on fait cela?
Données : lCl- =
76.10-4. lNH4+ =
74.10-4. lOH- =
198.10-4. lH3O+ =
350.10-4. Unités S.m2.mol-1.
Corrigé
Exercice n°3
On dispose
de deux flacons non identifiés. L’un d’eux contient une base forte, de la soude
et l’autre une base faible : de l’ammoniaque. Afin de les identifier et
d’en connaître la concentration, on a dosé 10 mL de la solution contenue dans
chacun de ces flacons par conductimétrie à l’aide d’acide chlorhydrique de
concentration C1 = 1.00 mol.L-1. Au début du dosage, dans
les deux cas, on a amené le bécher à 250 mL à l’aide d’eau distillée.
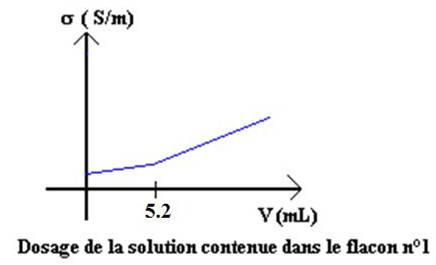
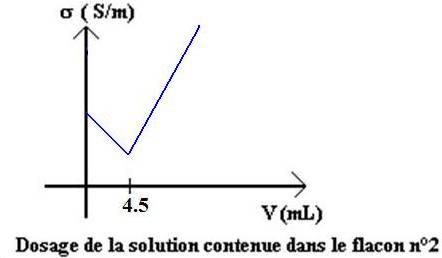
On obtient
les courbes données ci-dessous pour les deux dosages.
1.
Ecrire les
équations de mise en solution (dans l’eau) de l’acide chlorhydrique, de
l’ammoniaque et de l’hydroxyde de sodium.
2.
2.1.
Ecrire l’équation
de dosage de la soude par l’acide chlorhydrique.
2.2.
Etablir une
formule littérale indiquant la concentration de cette base CNaOH, en
fonction du volume d’acide versé à l’équivalence V1 et de la prise
d’essai E.
3.
3.1.
Ecrire l’équation
de dosage de l’ammoniaque par l’acide chlorhydrique.
3.2.
Etablir une
formule littérale indiquant la concentration de cette base, CNH3, en
fonction du volume d’acide versé à l’équivalence V1’ et de la prise d’essai E.
4.
4.1.
Que représente
« σ » sur les graphiques ? Expliciter l’unité
« S/m ».
4.2.
D’après l’allure
des deux courbes, attribuer un nom à chaque flacon.
4.3.
Commenter
l’allure de la courbe représentant le dosage de la soude par l’acide
chlorhydrique.
4.4.
Commenter
l’allure de la courbe représentant le dosage de l’ammoniaque par l’acide
chlorhydrique.
5.
Expliquer
pourquoi on a ajouté 250 mL d’eau distillée dans le milieu réactionnel en début
d’expérience ?
6.
Déterminer les
valeurs des concentrations des deux solutions de bases.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
NH4+ |
Cl- |
|
50.10-4 |
350.10-4 |
200.10-4 |
74.10-4 |
76.10-4 |
Corrigé
Exercice n°4
On dose une
solution d’ammoniaque de concentration Cb par une solution d’acide
chlorhydrique. La solution à doser est introduite dans la burette.
On verse dans le bécher 10
mL d’acide chlorhydrique de concentration ca = 0.100 mol.L-1
auxquels on ajoute 90 mL d’eau distillée. On suit l’évolution de la
conductance, G au cours du dosage.
|
VNH3 (mL) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
G (mS) |
4.26 |
3.75 |
3.05 |
2.50 |
1.95 |
1.50 |
1.52 |
1.47 |
1.50 |
On
donne :
La constante de cellule
est k = 10-2m.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
NH4+ |
Cl- |
|
50.10-4 |
350.10-4 |
200.10-4 |
74.10-4 |
76.10-4 |
1. Tracer le graphe G= f(V).
2. Ecrire l’équation de la réaction de dosage.
3. Interpréter l’allure de la courbe obtenue.
4. Déterminer la concentration Cb de la
solution S
5. Expliquer pourquoi on a joute 90 mL d’eau distillée à
la solution d’acide chlorhydrique contenue dans le bécher.
6. Conductivité, conductance :
6.1
Préciser les
unités, dans le système international, des grandeurs intervenant dans
l’expression de la conductivité s.
6.2
Exprimer la
conductivité de la solution du bécher pour VNH3 = 0 mL. Calculer sa
valeur théorique et en déduire celle de la conductance correspondante.
6.3
La conductance
est constante à partie de l’équivalence, déterminer sa valeur théorique.
Corrigé
Exercice n°5
On souhaite déterminer la
constante d’acidité Ka de l’acide méthanoïque HCOOH par conductimétrie. On
plonge la cellule conductimétrique dans une solution d’acide méthanoïque de
concentration c = 1.0 10-2 mol.L-1 et on trouve la
conductivité de la solution s = 5.10 10-2 S.m-1.
1. Ecrire les équations des équilibres ayant lieu en
solution.
2. Faire le bilan des espèces chimiques présentes en
solution et déterminer quelles sont les espèces majoritaires.
3. A l’aide d’un tableau d’avancement, donner
l’expression littérale du coefficient de dissociation, a, de l’acide méthanoïque.
4. Exprimer la conductivité, s, de la solution en fonction des concentrations des
ions à l’état final et en déduire la valeur numérique de a.
5. Déterminer les valeurs de Ka et pKa de cet acide.
6. On dose par conductimétrie l’acide méthanoïque
(bécher) par de la soude (burette). Ecrire l’équation du dosage.
7. Donner l’allure de la courbe obtenue s = f(V) et la justifier qualitativement.
Conductivités
molaires des ions, λ, en S.m2.mol-1.
|
Na+ |
H3O+ |
OH- |
HCOO- |
|
50.10-4 |
350.10-4 |
200.10-4 |
50.10-4 |
Corrigé
Exercice n°6 (BTS biochimiste (BIOAC) 1998)
Dans l’exercice suivant la
conductivité pourra être notée s au lieu de g comme dans l’énoncé
et la conductivité molaire pourra
être notéel.
