Exercice n°1
Pile Bouton.
On dispose d’une pile
bouton dont le schéma est donné ci-dessous.
Sa force électromotrice
est de 1.35V.
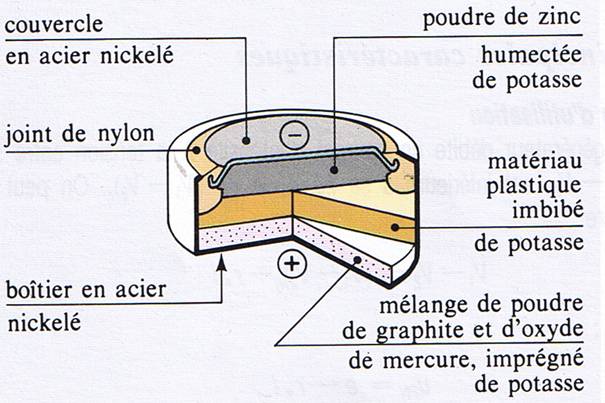
1. La réaction entre les ions zinc et la potasse (K++OH-)
forme le complexe Zn(OH)42-.
Ecrire l’équation de formation de ce complexe.
2. Quel est le rôle du graphite dans la partie inférieure
de la pile ?
3. Ecrire les équation rédox qui ont lieu aux électrodes
(d’abord sans tenir compte du milieu puis en milieu basique en équilibrant à
l’aide d’OH- au lieu de H+) couples : Zn2+/Zn
( milieu basique Zn(OH)42-/Zn) et HgO/Hg.
4. Cette pile bouton se présente sous la forme d’un
disque de 4mm d’épaisseur et de 1cm de diamètre. Elle peut débiter un courant
de 100mA pendant 1000h.
a- Déterminer sa capacité.
b- Déterminer son énergie totale.
c- Déterminer son énergie volumique.
d- Quelle masse minimale de zinc doit-elle
contenir ? (MZn = 65.4 g.mol-1).
Corrigé
Exercice n°2
Accumulateur au plomb
Un accumulateur au plomb
(batterie de voiture) peut être schématisé par une électrode de plomb et une
électrode inerte recouverte de dioxyde de plomb plongées dans une même solution
contenant de l’acide sulfurique et du sulfate de plomb.
1. Ecrire les deux demi-équations redox ainsi que la
réaction naturelle de la pile. E0Pb2+/Pb = - 0.13V et E0PbO2/Pb2+
= 1.45V.
2. Quelle est la force électromotrice de cette pile en conditions
standards ?
3. Sachant qu’on est en solution aqueuse et en milieu
acide, montrer que PbO2 et Pb sont consommés par des réactions
parasites même lorsque l’accumulateur est en circuit ouvert. E0O2/H2O
= 1.23V et E0H+/H2
= 0.00V.
4. Cette batterie a une capacité de 133 Ah et elle est
employée sous une intensité de 90A pour le démarrage de la voiture. Quelle
masse minimum de dioxyde de plomb doit-elle contenir ?
MPb
= 207 g.mol-1 et MO = 16g.mol-1.
Corrigé
Exercice n°3
Electrolyse d’une solution de
chlorure de sodium
(saumure).
On réalise l’électrolyse
du chlorure de sodium sous une tension de 3.8V et une intensité de 45kA.
On observe un dégagement
de dichlore à l’anode et un dégagement de dihydrogène à la cathode, et l’apparition
d’ions OH- (le milieu devient basique).
1. Faire la liste des espèces chimiques en solution et en
déduire qui sont les meilleurs oxydants et réducteurs présents.
E0Na+/Na
=-2.71V ; E0H2O/H2 =-0.42V (s’équilibre
avec OH-) ; E0O2/H2O =0.81V ( dans
les conditions expérimentales); E0Cl2/Cl-=2.4V
2. L’électrolyse observée est-elle celle qui était
prévisible (justifier) ? Comment expliquer ce résultat ?
3. Calculer la masse de dichlore produite en 1 jour (MCl
= 35.5g.mol-1).
4. Quelle est l’énergie consommée par tonne de dichlore
produite ?
Corrigé
Exercice n°4
Electrolyse
d’une solution de sulfate de cuivre à anode soluble (voir TP). E0Cu2+/Cu
= 0.34V.
1. Faire un schéma de cette électrolyse (l’anode est en
cuivre et la cathode en graphite).
2. Quelle est la force contre électromotrice de l’électrolyseur
dans ces conditions ?
3. Comment varie la concentration en ions Cu2+
dans la solution, d’après l’équation de cette électrolyse ?
4. L’anode est un fil de 1mm de diamètre et de 4 cm de
long (cylindre). L’intensité qui traverse l’électrolyseur est de 200 mA. Au bout
de combien de temps l’anode sera-t-elle totalement consommée ?
Donnée : Masse
volumique du cuivre : r = 8.92 103 kg.m-3 et MCu = 63.5 g.mol-1.
Corrigé
Exercice n°5
1. On veut nickeler un objet en cuivre. Peut-on
y arriver en le plongeant dans un bain de sulfate de nickel (Ni2+ +
SO42-) ?
2. On procède à un dépôt par
électrolyse. Indiquer un schéma possible de protocole expérimental.
3. On veut déposer sur une plaque polie
d’aire 350 cm2, une couche de 0.02 mm de nickel. Quelle est la masse
de nickel nécessaire ?
4. Quelle la charge électrique qui a été
transférée d’une électrode à l’autre pour obtenir ce résultat ?
Masse volumique du Nickel : r = 8.90 103 kg.m-3
MNi = 58.7 g.mol-1. E0Cu2+/Cu
= 0.34V et E0Ni2+/Ni = -0.23V
Corrigé
Exercice n°6
On effectue
l’électrolyse de l’iodure d’hydrogène (H++I-). On observe
un dégagement de dihydrogène sur une des électrodes et une coloration jaune,
caractéristique du diiode au niveau de la seconde électrode.
1. Ecrire les équations de réactions qui ont lieu aux
deux électrodes. Préciser à quelle borne du générateur elles ont lieu.
2. L’électrolyse observée est-elle celle qui était
prévisible ? Justifier.
Données :
E0H+ /H2 =0.00V ; E0O2/H2O =1.23V ;
E0I2/I-=0.62V