Exercice n°1
La vitamine
c est de l’acide ascorbique de formule C6H8O6
que l’on considérera comme un monoacide. On dissout un comprimé contenant cette
vitamine dans 100.0 cm3 d’eau distillée et on dose cette solution A par
une solution d’hydroxyde de sodium à 3.00 10-1 mol.L-1.
Seules les
réactions acido-basiques seront prises en compte.
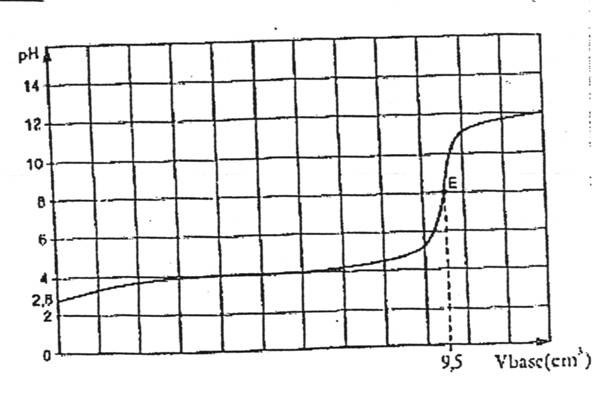
On obtient
la courbe ci-dessous.
1- L’acide ascorbique est il un acide fort ou
faible ? Justifier. Ecrivez l’équation bilan de sa réaction avec l’eau
puis la soude.
2- A l’aide de cette courbe déterminez :
a- le pKa du couple acide base étudié.
b- La concentration de l’acide dans la solution A et la
masse d’acide ascorbique dissoute dans les 100.00 cm3 d’eau.
3-
a- Déterminer les concentrations de toutes les espèces
présentes dans la solution A.
b- Déduisez Ka et pKa et comparer au résultat du 2a.
4- Calculer le facteur d’ionisation de l’acide dans la
solution A. Conclure. (On rappelle que le facteur d’ionisation est le rapport
du nombre de molécules ionisées au nombre de molécules mises en solution.)
Données : MC=
Corrigé
Exercice n°2
On considère
une solution aqueuse d’hydrogénosulfate de sodium, NaHSO4 de
concentration 0.01 mol/L.
Ce composé
est totalement ionisé en solution aqueuse en ions Na+ et HSO4
- .
L’ion
hydrogénosulfate se comporte dans l’eau comme un monoacide faible.
a- Ecrire l’équation bilan de mise en solution de cet ion
dans l’eau. Identifier les couples acido-basiques en présence. Donner
l’expression du Ka de cet ion.
b- A l’aide du tableau d’avancement, établir l’expression
littérale de la concentration de toutes les espèces chimiques présentes en
solution.
c- Le pH mesuré de cette solution est égal à 2.2. En
déduire les valeurs des concentrations
de toutes les espèces chimiques présentes en solution. Calculer la constante
d’acidité Ka de l’ion HSO4 - . En déduire son pKa.
d- Est ce un acide plus fort que l’acide éthanoïque dont
le pKa est égal à 4.75 à la même température.
Corrigé
Exercice n°3
1. Une solution de méthylamine CH3-NH2
de concentration molaire Cb = 0.2 mol.L-1 a un pH=12.
a- Ecrire l’équation de la réaction de
l’éthylamine avec l’eau.
b- Calculer les concentrations de toutes
les espèces chimiques en solution.
c- Calculer la constante d’acidité Ka du
couple CH3NH3+/CH3NH2 et
son pKa.
d- Le pKa du couple NH4+/NH3
vaut 9.2. La méthylamine est-elle une base plus faible ou plus forte que
l’ammoniaque ?
2. On mélange 10 mL de solution de
méthylamine de concentration Cb = 0.2 mol.L-1 à un volume
Va d’acide chlorhydrique de concentration molaire égale à 0.1 mol.L-1.
a- Ecrire l’équation bilan de la
réaction.
b- Quel est le volume Va nécessaire pour
réaliser une solution tampon dont le pH est égal au PKa du couple CH3NH3+/CH3NH2 ?
c- Quelles sont les propriétés des
solutions tampons ?
On suppose que les mélanges se font sans variations de
volume.
Corrigé
Exercice n°4
On dose au
pHmètre 100 mL d’une solution d’acide éthanoïque par de l’hydroxyde de sodium
de concentration molaire égale à 0.10 mol.L-1.
1- Quelles électrodes faut-il utiliser pour ce
dosage ?
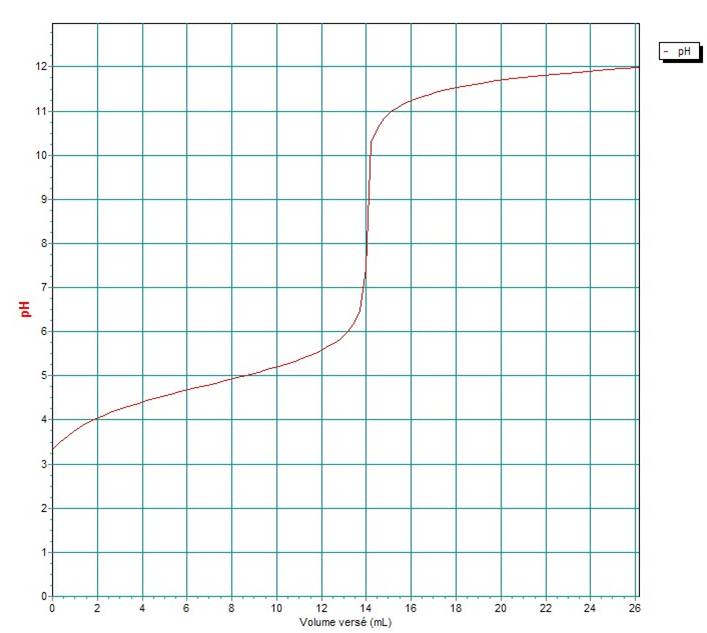
2- Déterminer sur la courbe le pH et le volume de soude
au point équivalent.
3- En déduire la concentration initiale C0
d’acide éthanoïque.
4- Quelle constante caractéristique peut-on déduire à la
demi-équivalence ?
5- Etablir la relation donnant le pH de la solution
initiale d’acide éthanoïque en fonction de C0 et de la constante
trouvée précédemment. Calculer la valeur de ce pH et la comparer à celle qui
est lue sur le graphe.
6- Quel indicateur coloré conviendrait pour repérer
l’équivalence de ce dosage ?
7- Citer une autre méthode instrumentale de dosage de
l’acide éthanoïque.
|
Indicateur |
couleur |
pH |
pH |
couleur |
|
Phénolphtaléine |
incolore |
8.2 |
9.8 |
Rouge-violet |
|
Rouge de méthyl |
rouge |
4.4 |
6.2 |
Jaune -orange |
|
BBT |
jaune |
6.0 |
7.6 |
bleu |
Courbe
de dosage :
Corrigé
Exercice n°5
On dose 20
cm3 d’une solution d’acide éthanoïque de concentration Ca par une
solution d’hydroxyde de sodium de concentration Cb et, à l’aide d’un pH-mètre,
on suit l’évolution du pH. On obtient le tableau suivant :
|
Vb (cm3) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
pH |
2.85 |
3.8 |
4.2 |
4.4 |
4.6 |
4.7 |
4.8 |
4.9 |
5.1 |
|
|
Vb (cm3) |
9 |
9.5 |
9.8 |
10 |
10.2 |
10.5 |
10.8 |
11 |
12 |
13 |
|
pH |
5.4 |
5.9 |
7 |
8.75 |
10.5 |
11.4 |
11.8 |
12 |
12.4 |
12.6 |
1- Ecrire l’équation de réaction de dosage.
2- Tracer la courbe pH=f(Vb).
3- Déterminer graphiquement les coordonnées du point
équivalent et la valeur du pKa du couple CH3COOH/CH3COO-.
4- En utilisant le pH initial, déterminer la valeur de la
concentration de l’acide éthanoïque Ca et en déduire celle de la solution
d’hydroxyde de sodium Cb.
5- Parmi les indicateurs colorés suivants, lequel
pourrait-on choisir pour repérer l’équivalence ?
|
Indicateur |
couleur |
pH |
pH |
couleur |
|
Phénolphtaléine |
incolore |
8.2 |
9.8 |
Rouge-violet |
|
Rouge de méthyl |
rouge |
4.4 |
6.2 |
Jaune -orange |
|
BBT |
jaune |
6.0 |
7.6 |
bleu |
6- Comparer la force de cet acide à celle de l’acide méthanoïque
sachant que le pKa de HCOOH/HCOO- est 3.8.
7- Donner deux
méthodes, sans calculs, permettant d’obtenir une solution tampon de pH égal au
pKa du couple CH3COOH/CH3COO- à partir de la
solution d’acide éthanoïque précédente.
Corrigé
Exercice n°6 (BTS AB
2006)
On donne :
NH4+/NH3
pKa = 9.20 à 25°C
11H et 714N
L’ammoniac est un gaz
moléculaire de formule NH3n très soluble dans l’eau.
1- Structure.
1.1 Ecrire le modèle de Lewis de la molécule d’ammoniac.
1.2 Prévoir la géométrie de l’ammoniac à l’aide de la
théorie VSEPR (règles de Gillespie).
2- pH d’une solution. L’ammoniaque est une base faible,
son acide conjugué est NH4+
2.1
En utilisant le
modèle de Lewis, justifier le caractère basique de l’ammoniaque.
2.2
Ecrire la
réaction qui a lieu lors de l’introduction de l’ammoniaque dans l’eau.
3- On souhaite préparer une solution tampon à partir
d’ammoniac.
3.1
Qu’est ce qu’une solution tampon ?
3.2
Sans calcul, donner l’ordre de grandeur du pH d’un tampon ammoniacal.
3.3
Citer un milieu naturellement tamponné.
Corrigé
Exercice n°7 (BTS BT
2007)
Soit une solution aqueuse SA
contenant de l’acide méthanoïque à la concentration c= 2.30 mmol.L-1.
1- Cette solution
présente à 25.0 °C un pH égal à 3.25.
a- Ecrire la réaction de dissociation de l’acide dans
l’eau puis donner l’expression de la constante associée.
b- Exprimer les concentrations molaires [HCOOH] et [HCOO-]
en fonction de c et du pH.
c- En déduire les valeurs de Ka et de pKa, cette dernière
étant donnée avec deux décimales.
2- On mélange la solution précédente à une solution SB
de base forte (K++OH-) de concentration c’ = 8.00 mmol.L-1 ;
les volumes employés sont respectivement : VA = 100.0 cm3
et VB = 50.0 cm3.
a- Ecrire l’équation de la réaction prépondérante
intervenant au cours de ce mélange.
b- Quel est le réactif en excès ? Justifier.
c- Déterminer les concentrations molaires de toutes les
espèces majoritaires et le pH du milieu à l’état final.
Donnée :
le produit ionique de l’eau est égal à 1.00 10-14 à 25°C.
Corrigé
Exercice n°8 (BTS AB
1993)
On souhaite réaliser une
réaction enzymatique dans un milieu tamponné à pH = 7.4.
1. Connaissant les pKa de l’acide phosphorique (H3PO4),
indiquer quel est le couple qui permet de réguler ce pH. Justifier la réponse.
Que peut-on dire des autres espèces dérivant de l’acide phosphorique ?
pK1
= 2.15 pK2 = 7.2 pK3 = 12.3
2.
a- Ecrire la réaction prépondérante qui a lieu à pH =
7.4.
b- Calculer le rapport des concentrations des deux
espèces prédominantes.
c- Sachant que la concentration totale de ces deux
espèces est 0.450 mol.L-1, en déduire la concentration de chacune
d’elles.
3. La réaction enzymatique étudiée libère 5.0 10-2
mol.L-1 d’ions H3O+.
a- Quel sera le pH de ce milieu tamponné ?
b- Quel serait ce pH dans l’eau pure, en l’absence de
tampon ?